2.7.2還元型標準物質の測定
これまでは酸化状態で溶存している酸化還元物質を変換ストリッピングに適用させた例を述べて来たが、変換ストリッピング法は還元状態で溶存している可逆な酸化還元物質にも適用可能である。以下では、還元状態で溶存している標準物質として適当な水溶性フェロセンを変換ストリッピングに適用した結果について述べる。
水溶性フェロセンの変換ストリッピング法による検出メカニズムおよび方法はルテニウムヘキサミンの場合に類似している。異なる点は、酸化反応と還元反応が逆になり、それに伴い電子の向きも逆になる点である。図12に示したように前電解段階ではジェネレーターで酸化、コレクターで還元反応が起きるためにコレクターの還元反応で必要となる電子はマクロ電極から供給しなければならない。
これはマクロ電極への析出物質としてハロゲンイオンを選ぶことによって可能となる。実験では析出電位が適当なヨウ素イオンを用いた。またヨウ素イオンを析出するマクロ電極としては銀電極を用いた。ストリッピングの段階では、ヨウ素イオンの溶解電流を観測することになるが、これはマクロ電極電位を正から負の方向に掃引する際のカソード電流(下に凸なピーク)を観測することによってなされる。
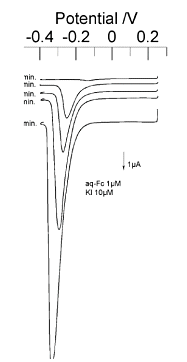
図13は水溶性フェロセンを変換ストリッピング法で検出した例である。水溶性フェロセンの濃度は1μ mol/dm3 でpH7.0 のリン酸緩衝溶液に溶解した。
析出用の溶液は0.1mmol/dm3 の硝酸カリウム水溶液中にヨウ化カリウムを溶解し濃度を1μmol/dm3 とした。前電解時間に依存して大きなカソード電流のピークが観測されたのに対して、水溶性フェロセンを含まない実験ではこのピークは観測されなかった。
このことから、水溶性フェロセンの電解に伴ってマクロ電極ではヨウ素イオンが析出し、析出したヨウ素イオンはストリッピング段階において溶解するメカニズムが確認され、還元状態で溶存している試料においても変換ストリッピング法は有効であることが示された。
これまでは、変換ストリッピング法を定量分析技術として、微量物質の検出の可能性を見てきたが変換ストリッピング法は微量物質の定性分析技術としての可能性も有している。
図14は水溶性フェロセンの変換ストリッピングを前電解電位を変化させて得られたストリッピングピークを前電解電位の関数としてプロットしたものである。前電解電位が水溶性フェロセンの酸化還元電位よりも低い場合はストリッピングピークは現われないが、前電解電位が酸化還元電位に近づくにつれてピークは大きくなり、酸化還元電位より十分高い前電解電位では、ピークの大きさは一定値になった。
測定値はシグモイド関数にフィティングさせることができた。酸化還元電位の意味を持つフィティングパラメータは非線形最小二乗法で0.38V と求めることができ、これは水溶性フェロセンの酸化還元電位の値と一致した。
この測定はくし形電極をツインモードでサイクリックボルタメトリーを行ったことと同等であるが、検出電流が非常に大きく増幅されているために、低濃度試料のサイクリックボルタンメトリー測定が可能であることを示してる。
しかし、この測定は一点を得る毎に前電解を行わねばならず長時間の測定時間が要求される。これはくし形電極とマクロ電極の組を多数配置した電極系で変換ストリッピングを行うことによって解決されよう。
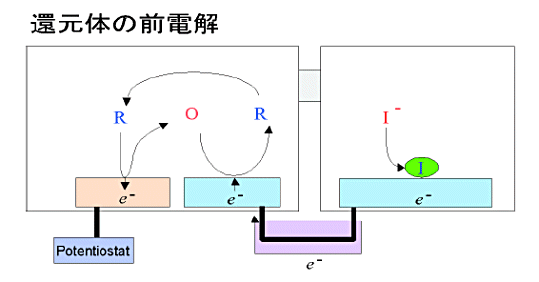
図12. 還元状態で溶存している可逆な酸化還元物質の前電解メカニズム。酸化状態で溶存している場合とでは、各電極での酸化、還元反応が逆。くし形電極とマクロ電極間に流れる電流の向きも逆。析出物質はアニオン。