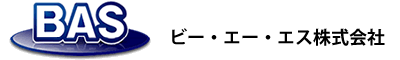2.7.4ドーパミンの高感度選択的検出
くし形電極の電極幅とギャップの微小化によって精度の高い測定が可能になり、感度を向上させ、応答速度を高速にすることが期待できることを述べてきた。これらを実証するために、生体中に微量存在し、重要な役割を果たしているカテコールアミンの1種のドーパミンについて検討した結果を述べる22。
ドーパミンは、フェロセンのような典型的可逆性物質と比較すると、電極反応を起こす電子移動速度も遅く、さらに不安定(高いpH 下)で電気化学反応に引き続いて起こる化学反応によって経時変化を引き起こし易い物質である。従って、このような微小電極を用いることによって、G極で発生したレドックス種を極めて短時間でC極で捕捉できるため、不安定な中間体を捕まえ、元に戻す効果が顕著に出現することが期待される。
図16はドーパミンを、GC モード、O モードでCV 測定を行なったものである。通常の測定法にあたるO モードでは非対称のピーク波形であるが、GC モードでは大きな限界電流が観測され、高感度測定の可能性を示している。
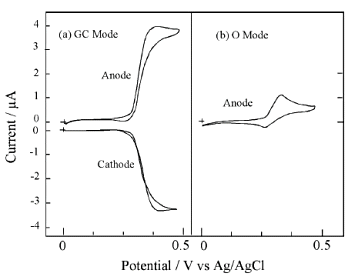
図17は、低濃度での測定例である。100nM においては、G極のアノードでも定量可能な曲線を観測でき、充電電流のノイズのないC極では、きれいな限界電流が観測される。
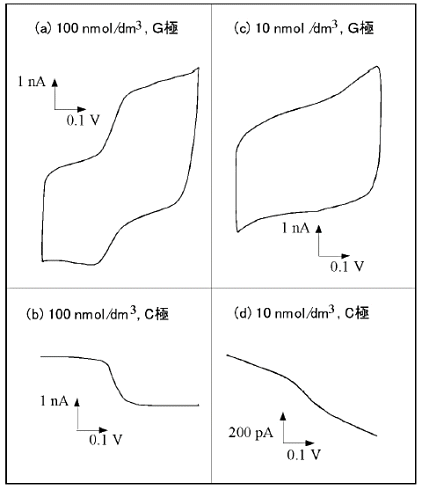
さらに1桁低濃度の10 nM では、アノード側の定量的カーブは得られないが、カソード側では、残余電流によるベースラインの傾きが見られるものの定量可能な測定ができた。広い濃度範囲にわたって酸化還元に伴う限界電流が観測され、濃度と電流値はよい直線関係を示した(図18)。これは微小くし形電極が微量成分の定量的検出に有効であることを示唆している。
ドーパミンの測定に於て高感度検出が可能なことを示したが、実際の系では測定の妨害となるL-アスコルビン酸が多量に共存する。このような系での反応は複雑であり、まずドーパミンが酸化されるが、すぐに共存するアスコルビン酸によって還元されるため通常の電極での選択的検出は不可能である。
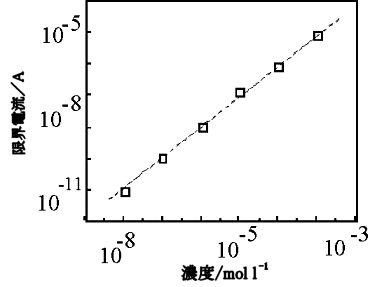
図19にサイズの異なる2種類のくし形電極を用いた場合のサイクリックボルタングラムを、ドーパミンのみとアスコルビン酸が共存する場合と比較して示す。比較的サイズの大きなくし形電極では(10μm 電極幅、5μm 間隙)、ドーパミンのみの場合、酸化側、還元側とも限界電流が観測されるのにたいし(a)、ドーパミンが6倍量アスコルビン酸の共存する系では、ノイズの小さな還元側でも明確な信号が観測されず、酸化側にアスコルビン酸によってメデイエーションされたピークとアスコルビン酸自体の酸化ピークが観測され(b)、ドーパミンの選択的検出はできない。すなわちここで使用したサイズの電極では、酸化種が還元電極へ拡散する間に、後続の反応によって変化してしまうことを示している。
一方、図19右側に示すように、より小さなサイズの電極では(3μm 電極幅、2μm 間隙)、混合系においてもドーパミンの限界電流を観測でき、ドーパミン酸化種が変化する前に還元極で検出されていることがわかる(d)。
このような選択性は、明かに電極形状に依存し、微小にするほど向上することが期待される。この微小くし形電極自身が有する選択性と高分子膜の修飾により更に大きな選択検出が期待できる。
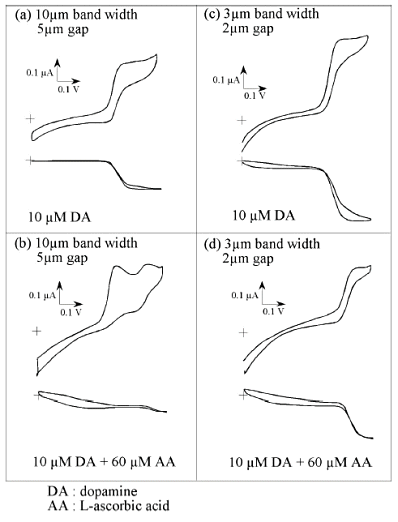
図20にドーパミン選択性に優れるナフィオン(上層)及び膜内部でのドーパミンの拡散性が大きいポリエステルアイオノマー(下層)の2層膜により修飾したくし形電極によりドーパミンの選択検出を行なった結果を示す23。サンプル中にはドーパミンに対して0から100倍の濃度のLアスコルビン酸が存在している。
測定はくし形電極のC電極にドーパミンの還元電位を印加しG電極をドーパミンの0Vから酸化電位までステップして行なった。サンプル中にアスコルビン酸が含まれていない場合、電位ステップ直後にC極側の電流は定常状態に達し、酸化されたドーパミンが膜中でも速い拡散速度を示していることが分かる。一方、ナフィオン単独膜で電極修飾した場合はドーパミンの膜中での拡散速度が低いため速い応答は得られず電流の絶対値も低下した。
次に、過剰のアスコルビン酸を含むサンプルではC極側の電流は始め低いが数秒後には増加し、アスコルビン酸を含まないサンプルで得られた値とほぼ一致した。電位印加直後には選択性の小さい下層膜にはLアスコルビン酸が存在するためG極で酸化されたドーパミンの大部分はC極に到達する前に還元される。しかしながら、ナフィオン膜の影響によりアスコルビン酸は溶液中より膜中に僅かづつしか供給されないため膜中濃度は急激に低下する。
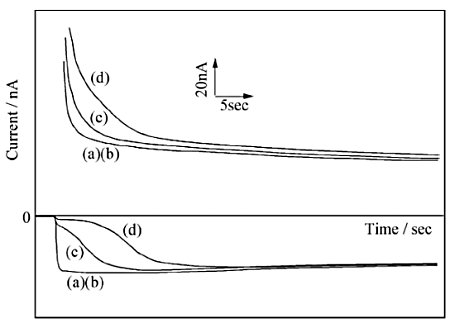
ドーパミン:10μM、Lアスコルビン酸、a:0 μM, b:200μM, c:600μM, d:1000μM
一方、可逆なドーパミンはC極の反応で再生され、濃度が変化しないため高い選択性が得られる。