1-11 化学反応が伴なう場合
電気化学 測定テクニックの1つであるクロノクーロメトリーは電極で起こる、不均一系酸化還元反応(電極電荷移動反応に伴なう均一化学反応、即ち溶液中の先行又は後続化学反応)の研究に適しています。そのような化学反応は予測でき、測定できるかたちにQ-t応答に変化を与えるので、化学反応機構や速度論に関する情報が得られます。次の EC 機構で示される後続化学反応の研究を、クロノクーロメトリーがどのように利用されるかの好例として示します。
E : O + e ⇄ R (9)
C : R → P (10)
EiからEsへの電位ステップによって O から電解還元されてできたRが反応活性種であり、反応速度 k で Pを生成します。この機構は EC と書き表わされますが、EはElectrode reaction 、C は Chemical reaction から来ています。R から Pを生成する均一化学反応はダブルポテンシャルステップクロノクーロメトリーで研究できます。反応速度kの大小によってEC 機構のクロノクーログラムがどのように変わるかを図1-7に示します。(k↑は速度定数が増加する方向)
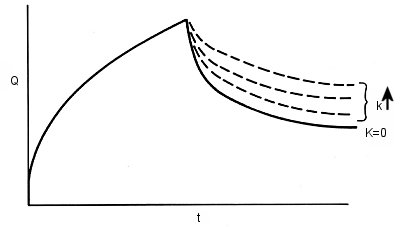
フォワードステップの間はクロノクーログラムは後続化学反応の影響は受けません。これは予期されることでOの電極表面への物質移動はCOとDOに依存しており電解生成したR がどうなるかは関係ありません。(勿論、Rが反応してOを生成しない場合であるが生成する時は別の機構を考えなければなりません)
クロノクーログラムのリバースステップ期は k の値に敏感に影響を受けます。kの値は理論から計算した無次元パラメータからなる作用曲線から求められます。EC 機構に対する作用曲線を図1-8に示します。
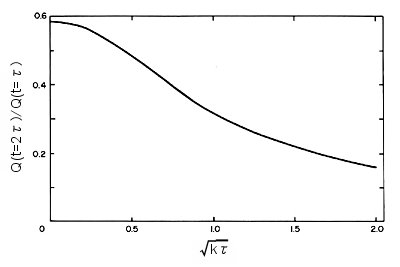
曲線は比Qr/Qfが(kτ)1/2の関数としてどのように変わるかを示しています。期間τのポテンシャルステップに対するQr/Qf を測定し作用曲線から対応する (kτ)1/2 の値を読み取り k を計算します。作用曲線の形は後続する化学反応の機構に依存します。化学反応の速度定数が大きくなるとQrは減少します。化学反応が速くなればなるほど、リバースステップ期にOへ再酸化されるRが減るのでQrは小さくなります。