トップページ > 電気化学測定用電極・セル > 参照電極一覧 > これから電気化学を始める方のための参照電極の基礎
電気化学測定に使用する参照電極の種類とその用途、選択方法についての基礎的な内容です。
その他はこちら
カロメル電極は、基準電極として古くから使われてきた。近年、環境問題から端を発して、使用にブレーキがかかってはいるが、重要な電極であることに変わりはなく、現在でも多くの文献でSHE以外に基準の表記に使われている。この電極の構造の一例を右図にあげる。
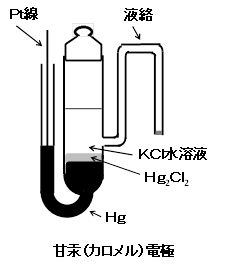
飽和KCl(約4.8M)を内部液として用いると塩化物イオンの活量が増える分、電位は負シフトして0.241Vとなる。活量の項には温度が係数としてかかっているので温度により変動する。1°C上昇すると0.5mV程度、負方向にシフトする。
飽和以外のKCl濃度における25°Cでの電位は、1Mでは0.2801V、0.1Mでは0.3337Vである。温度による変動は高濃度ほど大きい。
上図のような枝管付きでは不便な点があるので水銀極を上に配置する。水銀部の下部の流出を抑えるために絞り、その下に塩化第一水銀と水銀のペースト、その下をガラス繊維などで下支えする方式の方が一般的である(右図ビー・エー・エス RE-2BP)。
水系の参照電極を非水系で使えるかという質問をよく受けるが、使うことは可能である。但し、水や塩化物イオンによる汚染があっても構わない場合であって、それでも不明な液間電位(大きくなる可能性がある)があることや、液絡部の析出物の危険性を考えると非水系用の使用が勧められる。むしろそれより擬似参照電極として白金線をポテンショスタットの参照電極端子につないで、別途、内部標準(後記)を使う方が勧められる。擬似参照電極は小さなインピーダンスになる点でも勧められる。

電気化学測定に使用する参照電極の種類とその用途、選択方法についての基礎的な内容です。
その他はこちら
これから電気化学を始める方のための参照電極の基礎-その3:カロメル電極
甘汞電極(カロメル電極)では次式の平衡反応が起こっている。
Hg + Cl- ⇄ 1/2Hg2Cl2 + e
電極電位は次式で与えられる。
E =E0Hg2 2+ /Hg +RT/2F ln Ks(Hg2Cl2) - RT / F ln aCl-
溶解度積の文献値、Ks(Hg2Cl2)=2×10-18と、E0Hg2 2+/Hg = 0.7960V、使って計算するとaCl-=1のときE0 Hg/Hg2Cl2=0.273Vになる。
通常は塩化物イオンの活量aCl-を含む次式で与えられることが多い。
![]()
上の計算値と少しずれるがE0=0.268Vが知られている標準電位の値である(25°C)。
電極電位は塩化物イオンの濃度に依存し、1M KClでは0.280V、飽和KClでは0.241Vとなる。飽和KClの場合を、飽和カロメル電極(Saturated Calomel Electrode)の略称でSCEと呼ばれることが多い。

飽和以外のKCl濃度における25°Cでの電位は、1Mでは0.2801V、0.1Mでは0.3337Vである。温度による変動は高濃度ほど大きい。
上図のような枝管付きでは不便な点があるので水銀極を上に配置する。水銀部の下部の流出を抑えるために絞り、その下に塩化第一水銀と水銀のペースト、その下をガラス繊維などで下支えする方式の方が一般的である(右図ビー・エー・エス RE-2BP)。
水系の参照電極を非水系で使えるかという質問をよく受けるが、使うことは可能である。但し、水や塩化物イオンによる汚染があっても構わない場合であって、それでも不明な液間電位(大きくなる可能性がある)があることや、液絡部の析出物の危険性を考えると非水系用の使用が勧められる。むしろそれより擬似参照電極として白金線をポテンショスタットの参照電極端子につないで、別途、内部標準(後記)を使う方が勧められる。擬似参照電極は小さなインピーダンスになる点でも勧められる。

pdf資料はこちらからダウンロードできます(約140KB)
![]()
トップページ|電気化学 測定|電極&アクセサリ|光と電気化学|分光分析|お問い合わせ