トップページ > 電気化学計測 > これから電気化学を始める方のための基礎 > レドックス電位について
電気化学におけるレドックス電位についての基礎的な内容です。
その他はこちら
前回はフェロセンに関連して少し脱線したが今回は話を元に戻して、レドックス電位がどのような要因で決まるかを続けよう。有機遷移金属化合物の多くで、π
受容体であるカルボニル(CO)が配位すると電位がプラス方向に大きく傾く。これは、中心金属のd電子の内、π
対称性軌道から配位子の反結合性π
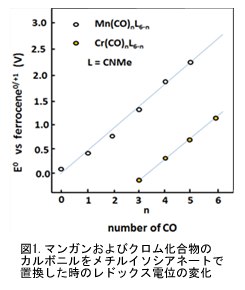
軌道に逆供与(バックドネーション)が起こり、結果として中心金属の電子密度が減るために起こる。金属カルボニル化合物は一般に高電位であり、カルボニルの数に比例して上昇する(図1)
ひるがえって、カルボニルから見ると反結合性軌道電子の増加になるのでC=O結合が弱まり、CO伸縮振動数の減少をまねく。それ故、赤外分光法から逆供与の程度を推算することが可能で、レドックス電位の測定とIR測定がしばしば併用される。図2の化合物についての例を以下に示そう1)。
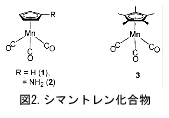
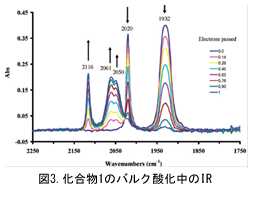
シクロペンタジエニルトリカルボニルマンガン(1)はフェロセン基準で0.92 Vに可逆な酸化還元を示す。バルク酸化電解中のカルボニル領域のIRスペクトルを図3に示す。酸化されるとともに1に帰属される低波数側の2つのピークが減衰、高波数側に1+に帰属される3つのピークが現れ、電解が進むとともに吸収強度が増大してゆく。酸化によりマンガン周りの電子が減り、逆供与が減少する。それ故、Mn-CO結合が弱まり、逆にCO結合が強くなる結果を反映している。シクロペンタジエニル環にアミノ基やメチル基が置換した2や3は、1よりレドックス電位は負方向である。これは置換基の電子供与性のためであり、逆供与を増やすのでCO伸縮振動数にも低波数シフトとして反映される(表参照)。
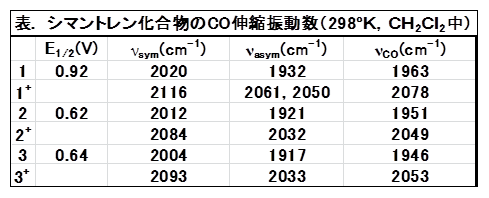
電気化学におけるレドックス電位についての基礎的な内容です。
その他はこちら
レドックス電位について(3):レドックス電位が決まる要因



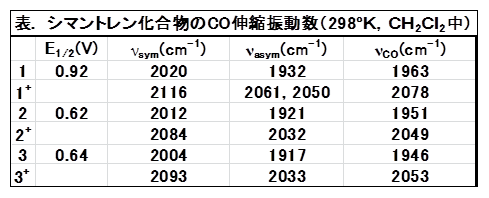
1)W.E. Geiger et al., J. Am. Chem. Soc., 130, 9859 (2008)