トップページ > 電気化学計測 > これから電気化学を始める方のための基礎 > レドックス電位について
電気化学におけるレドックス電位についての基礎的な内容です。
その他はこちら
前回ではt2g軌道がπ
*軌道との相互作用により押し下げられるため、レドックス電位が正方向に傾くと述べた。配位子に電子を供与するため金属周りの電子密度が減少する。結果として、金属中心が酸化され難くなるためレドックス電位が正方向にシフトするという見方もできる。あるいは、金属周りの電子密度が減少し、有効核荷電が増える。その結果、HOMO準位が低下(安定化)する。HOMO準位の低下はレドックス電位の正方向へのシフトにつながるという具合である。いづれにしても、結合するCOの数を増やすとレドックス電位は正方向にシフトする。逆に、COの数を減らすと(nを大きくすると)レドックス電位は負方向にシフトする。
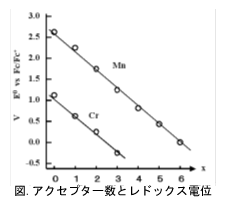
化合物M[(CO)6-x(CNR)x]で中心金属をCr(0)又はMn(I)としてxを変えたときのレドックス電位をプロットすると、右図のように直線的に変化する(Cr(0)、Mn(I)はそれぞれゼロ価、一価イオンの酸化状態。従って両化合物は等電子構造である)。しかも、CrとMnの直線はほぼ平行である。Pletcherらはこの関係に対して次式を与えた。

電気化学におけるレドックス電位についての基礎的な内容です。
その他はこちら
レドックス電位について(5):HOMOエネルギーとレドックス電位の直線関係
分子軌道計算によるHOMOエネルギーと有機金属化合物のレドックス電位の間の直線関係の代表例として、このシリーズの3回目でもふれたMn[(CO)6-n(CNR)n]+があげられる1)。CNRはアルキル又はアリルイソシアネートである。カルボニルはσドナーで、かつ強いπ アクセプターである。アルキルイソシアネートもσドナーかつπ アクセプターであるが、π アクセプター性はカルボニルほど強くない。前回でも述べたように、COが結合すると金属のd軌道のt2g電子(同じくπ 性である)がCOのπ *軌道(COの半結合性軌道)と強く相互作用し、金属からカルボニルへの逆供与が起こる。
化合物M[(CO)6-x(CNR)x]で中心金属をCr(0)又はMn(I)としてxを変えたときのレドックス電位をプロットすると、右図のように直線的に変化する(Cr(0)、Mn(I)はそれぞれゼロ価、一価イオンの酸化状態。従って両化合物は等電子構造である)。しかも、CrとMnの直線はほぼ平行である。Pletcherらはこの関係に対して次式を与えた。

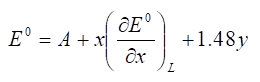
Aは用いる媒体(溶媒と支持電解質)や参照電極などによって決まる定数、xはカルボニルを置換する配位子の数、yは錯体の電荷である。yにかかる係数1.48は、カルボニル数が同じで等電子構造のカルボニル錯体についての実測値の平均から求められた値である(下表)。電荷を1つ増やすと1.48 V、正方向にシフトすることを意味する。この値は一般的に参考になる。
周期律表上、隣りあった原子で類似のレドックス系では、一般に原子番号の小さい金属が、より負電位にレドックス反応を示す傾向がある。ヘキサカルボニルのV、Cr、Mnの等電子錯体の系列でこの傾向が当てはまる。
[ V-(CO)6;-0.35 V、Cr(CO)6 ; +1.12 V, Mn+(CO)6 ; +2.62 V ]

1) Pickett, Pletcher, J. Organometal. Chem., 102, 327 (1975)